§ 2.6. Степени покрытия поверхности
Степень покрытия поверхности молекулами адсорбированных газов влияет на характер протекания поверхностных явлений: эмиссию электронов из твердого тела, поверхностный электрический разряд, сухое трение и износ, адгезию пленок и т. д.
Обозначим долю поверхности а/ат, занятую адсорбированными молекулами, буквой б и установим три степени покрытия поверхности: высокую (0>1), среднюю (0»1) и низкую (0<1). Для расчета равновесных значений 0 можно воспользоваться уравнением (2.17), позволяющим рассчитывать 8 при любых степенях покрытия.В тех случаях, когда время установления адсорбционного равновесия мало, 8 не будут достигать равновесных значений. Для определения влияния времени установления адсорбционного равновесия на долю поверхности, покрытой слоем адсорбированных молекул, необходимо решить дифференциальное уравнение адсорбции на гладкой поверхности. Для случая мономолекулярной адсорбции оно может быть записано в следующем виде:
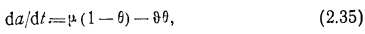
где da/dt — удельная скорость адсорбции; ц — удельная скорость конденсации на свободной поверхности; Ф— удельная скорость испарения с поверхности, покрытой мономолекулярным адсорбционным слоем.
Воспользовавшись выражениями (2.22) и (2.23), для удельных скоростей ц и Ф перепишем уравнение (2.35):
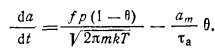
С учетом того, что a=am0, это уравнение можно преобразовать к виду

Здесь
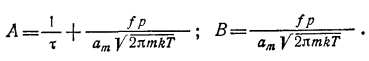
Решение уравнения (2.36) при начальных условиях t=0, 8 = 0о имеет вид
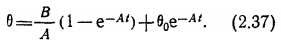
Его можно переписать следующим образом:
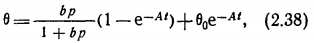
Где
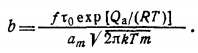
При t→∞ равновесная степень покрытия 0=aoo/am=bp/(l + +bр).
Если принять за равновесное состояние а=0,99а∞, то время достижения сорбционного равновесия при начальном условии 8о = 0
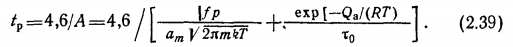
При адсорбции азота на графите для р = 1,33-10" Па; Т=293 К; ст=9,6-1018 м~2; /=1; то=10-3 с получим /Р=ЗХ Х10~И с, что говорит о том, что при высоких давлениях или температурах адсорбционное равновесие устанавливается практически мгновенно.
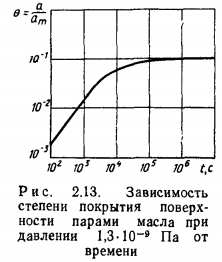
При низких давлениях или температурах адсорбционное равновесие устанавливается достаточно медленно. Так, для паров масла (М=422 кг/кмоль) при p=l,3-10~9 Па; Т=298 К; Qa =96-106 Дж/кмоль; cm=6,67-1017 1/м2 получим *рж105 с, т. е. величину, соизмеримую с временем эксперимента (рис. 2.13).
Скорость сорбции q найдем, дифференцируя по времени (2.37):
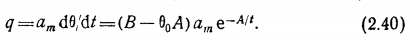
Если B>Q0A, то наблюдается адсорбция, если £<0ОЛ, то — десорбция.
Время, в течение которого скорость десорбции снижается при до заданного значения, можно получить из (2.40):
![]()
где qд — скорость десорбции, равная заданному значению минимального газовыделения.
Это уравнение можно преобразовать к виду lgqa=Ai—В1tд, удобному для обработки экспериментальных данных.
Если время эксперимента меньше времени установления адсорбционного равновесия, то для расчета 0 вместо (2.17) нужно пользоваться уравнением (2.37).
